3.3 物質の状態
百聞は一見にしかず、と言います。人は皆日常生活で眼にする状態を基準に物事を判断して、周囲の人々と意見交換をしたうえで、知識を蓄積します。物事を突き詰めて考えていくと、見た目だけでは理解できないことに気づき、望遠鏡や顕微鏡などの器具を使って目を見張る新しい世界を見つけてきました。科学技術の世界に限らず、いろいろな考え方や解釈がまことしやかに語られていますが、どの範囲を見て、どの時間範囲で物事を語るかにより、捉え方は大きく変化します。
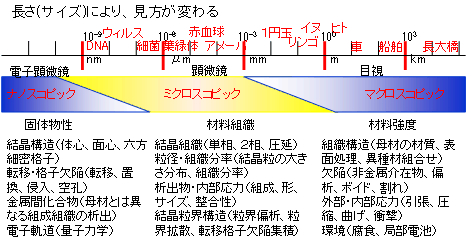
右図に金属構造物を理解するうえで代表的な長さ(サイズ)と興味の対象の関係の概略を示します。数字だけではピンとこないので、日頃眼にしている生物や構造物及びミクロサイズの生態関連物質の概略の大きさを併せて示しています。この節で考えるのは、非常に小さい世界の話、電子顕微鏡で見えるか見えないかの大きさの世界を対象とした現象です。
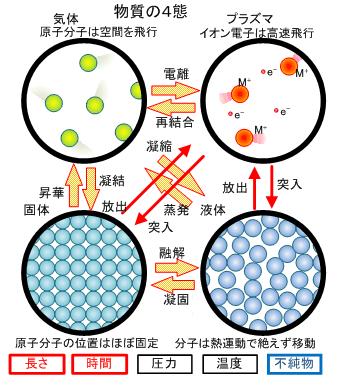 物質の状態には、(1)固体、(2)液体、(3)気体の3態があると説明されます。日常生活ではそれで十分なのですが、アーク溶接の場合には、気体構成元素の一部が電離した(4)プラズマ状態が重要です。アーク溶接を考える場合には、物質の状態には4態あるとして説明します。プラズマとは言いながら、構成粒子全てがイオンと電子に電離している訳ではなく、ほんの数パーセントが電離した状態をプラズマとして説明しています。その点に注意をして置くことが重要です。溶接アークは非常に高温だという先入観から100%近く電離していると思い込み勝ちですが、数%程度しか電離していない領域がアークの大部分を占めています。
物質の状態には、(1)固体、(2)液体、(3)気体の3態があると説明されます。日常生活ではそれで十分なのですが、アーク溶接の場合には、気体構成元素の一部が電離した(4)プラズマ状態が重要です。アーク溶接を考える場合には、物質の状態には4態あるとして説明します。プラズマとは言いながら、構成粒子全てがイオンと電子に電離している訳ではなく、ほんの数パーセントが電離した状態をプラズマとして説明しています。その点に注意をして置くことが重要です。溶接アークは非常に高温だという先入観から100%近く電離していると思い込み勝ちですが、数%程度しか電離していない領域がアークの大部分を占めています。
以下では原子や分子及び電子を含めた全ての構成物質を粒子と呼ぶことにします。固体、液体、気体などの物質の状態は、温度や圧力によりその状態が変化し、これを状態変化と言います。固体と液体の間の変化を融解(液化)・凝固(固化)、気体と液体の間の変化を蒸発(気化)・凝縮(液化)、ドライアイスなどのように固体と気体に直接変化する関係を昇華・凝結と言います。
固体では、粒子間の距離は小さく、大きな粒子間力が働き、金属結合や共有結合あるいはイオン結合など物体固有の結合の仕方で結び付けられています。固体の中では粒子は規則的に配列(結晶格子)していることが多く、個々の粒子は結晶内部の決められた位置で熱振動しています。圧力や熱の変化による体積変化は気体と比較すると極めて小さく、形も変化しにくいのが特徴です。液体から固体へと変わるときに、ゆっくりと固化する場合には、綺麗な結晶が成長し、上手に成長させれば単結晶が生成します。一般的には、比較的短い時間で固化するので、空間中の種となる物質が存在する多くのところで、個々に結晶成長が始まります。この場合には、他の位置で成長を始めた結晶どうしが出会うところ(粒界)で、少し困った問題が生じます。成長方向が異なることによる非整合性と、最後まで固化しきれていない融液には不純物が比較的多く残存することです。また、鉄のように固体状態での温度変化により結晶構造が変態する金属では、大きな歪が生じて変形することがあります。普通の固体はきれいに整列した結晶構造ですが、ガラスに代表される、構造がばらばらな非晶質(アモルファス)の物質もあります。
液体を構成する粒子は、固体のように互いに近接して存在しています。このため、液体の密度は固体とほぼ同じです。液体中の個々の粒子は固体に比べると激しく熱運動をし、互いの位置関係には本質的に規則性がありません。液体粒子は複数の原子が結合した分子で構成され、分子が球対称の形状になることはなく、構造上プラスマイナスの電荷は偏り(極性)を持ちます。相互に密接に存在する個々の粒子は、この極性により局所的に規則的に配列した構造を保つ場合があります。この秩序性(クラスター)は数粒子離れると無くなり、ランダムに流動します。固体では秩序正しい配列が長距離まで保たれるのに対して、液体の場合には秩序性が無く平均的な振る舞いのみが目立ち、諸性質は等方性を示します。粒子間にはある程度の間隙があり、この隙間に近傍の粒子が入り込むため、結果的に形を容易に変える流動性が表れます。
水は特殊な例外ですが、液体での粒子間距離は固体より少し大きく、固体と違い個々の粒子の位置は時々刻々と変化します。別の粒子からの粒子間力を受けますが、体積はほぼ一定のままです。水以外の一般的な液体は、エタノールやベンゼンなどの炭化水素で構成された分子性液体で、有機溶媒といわれています。金属や合金は金属元素の原子を構成単位とした物質で、融点以上の高温になると液体になります。この液体金属は正電荷の金属イオンと負電荷の電子との間の相互作用により金属原子間に結合が生じています。
気体は個々の粒子が結合と言う呪縛を逃れ、ある程度自由に空間を飛びまわれる状態になったものです。気体粒子は自由かつランダムに動き(熱運動)、相互の距離は長く粒子間の引力(分子間力)は働きません。気体粒子の大きさ・質量共に気体の体積に比べてはるかに小さく、気体状態では物質の種類を問わずに共通の性質が表れやすくなります。例えば同一温度同一気圧では、気体の種類を問わず同一体積中に含まれる分子数は一定(アボガドロの法則)となります。通常では固体や液体より粒子間の距離がはるかに大きく、そのため密度は最も小さくなります。また、圧力や温度により体積が大きく変化します。構成粒子間でのやりとりは少なく、熱の伝導は低くなります。
プラズマは構成粒子の一部が電離し、元の粒子とほぼ同じ重さのイオンと、非常に軽量な電子とに分離します。電磁気的な力が作用することと、電子の飛行速度が非常に速いことが大きな特徴となります。右の画像は パルスアーク(アーク電流の強弱を時間的に変動させる方法)をSUS304の円筒形状の陽極に発生させた例です。強い電流が流れる(ピーク)時には陽極上の溶融金属量は増加し、弱い電流が流れている期間(ベース電流)円筒状電極の下部へ熱が移動し、溶融金属は円筒陽極で凝固を始め、溶融金属量は減少し結果的に先端部に収縮していきます。強弱期間の交代がある程度ゆっくりした周期では、溶融・凝固の状態変化がはっきりしていますが、交代周期が早くなると熱的な応答が間に合わなくなります。固体、液体、気体、プラズマの4つの異なる状態の特徴を直感的に理解できる映像です。
パルスアーク(アーク電流の強弱を時間的に変動させる方法)をSUS304の円筒形状の陽極に発生させた例です。強い電流が流れる(ピーク)時には陽極上の溶融金属量は増加し、弱い電流が流れている期間(ベース電流)円筒状電極の下部へ熱が移動し、溶融金属は円筒陽極で凝固を始め、溶融金属量は減少し結果的に先端部に収縮していきます。強弱期間の交代がある程度ゆっくりした周期では、溶融・凝固の状態変化がはっきりしていますが、交代周期が早くなると熱的な応答が間に合わなくなります。固体、液体、気体、プラズマの4つの異なる状態の特徴を直感的に理解できる映像です。
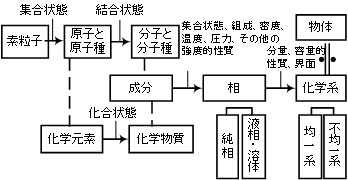
右図に物質に関する大まかな分類を示します。金属に関しては仕事に必要な内容はある程度勉強しましたが、化学系の勉強はあまりしておらず、定年を機に物理や化学をある程度基礎的に勉強しなおし、若いときにもう少しきちんと勉強しておけば、理解力がもう少しましであったのにと後悔しています。
次ページ 2016.03.12作成 2026.01.10改訂